La membrane des cellules : une mosaïque fluide
En 1925, on sait déjà que la membrane plasmique est composée
d'une bicouche de phospholipides. Les phospholipides sont des types de molécules possédant
une "tête" hydrophile (soluble dans l'eau) et une "queue" hydrophobe constituée de deux chaînes d'acides gras. Une telle molécule, dont une extrémité
est hydrophile et l'autre hydrophobe, est dite amphipathique
ou amphilitique.
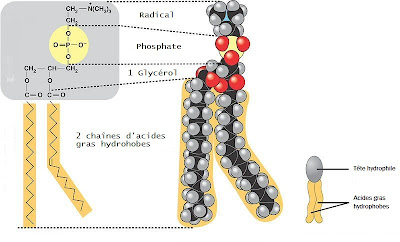 |
| Structure et composition d'un phospholipide |
L’être vivant est composé à 80% d’eau, comment l’eau
peut-elle traverser la membrane de la cellule ? L'hypothèse de l'existence de
canaux protéiques implantés dans les membranes cellulaires
et permettant ainsi un échange rapide de molécules d’eau entre une cellule et
son millieu extérieur, a souvent été évoquée. En
1970 déjà, Robert Macey montrait que la perméabilité à l'eau des
globules rouges était bien supérieure à celle correspondant à une
bicouche lipidique, et que cette propriété était fortement réduite lorsque les
cellules étaient traitées avec des agents mercuriques connus pour
complexer les protéines membranaires.
En 1972, Jonathan S. Singer et Garth L. Nicholson décrivent le modèle aujourd'hui universel de la mosaïque fluide.
La membrane est toujours organisée en bicouche mais les têtes polaires
des phospholipides sont directement en contact avec l'eau. Les protéines membranaires « flottent » dans ou en surface des lipides constituant la membrane.
| Le modèle de la "mosaïque fluide" de Singer et Nicholson |
La mise en évidence d'un type de canaux hydriques : les aquaporines
En 1974, l’équipe de Jacques Bourguet mettait en évidence pour la première fois, grâce à la
microscopie électronique, la présence de protéines intramembranaires
correspondant à des canaux hydriques sur des vessies d’amphibiens dont la
perméabilité osmotique était augmentée par la vasopressine (hormone antidiurétique).
Dans les
années 80, Jean Pratz et son équipe démontraient
que des protéines membranaires permettant le passage de l’eau
existaient non seulement à la surface des globules rouges, mais aussi dans les
membranes des cellules rénales responsables de 80% de la réabsorption
de l’eau filtrée par le rein.
C’est en 1991 que Peter Agre, alors à la recherche de protéines antigéniques, isolait à partir de cellules de foie fœtal un ADN complémentaire d’une protéine d’un poids moléculaire d'à peu près 28 kD. L’année suivante, il démontrait que cette protéine exprimée dans des ovocytes d’un batracien, le Xénope, augmentait la perméabilité à l’eau de ces ovocytes, et qu'elle pouvait être inhibée par des agents mercuriques, comme l'avait observé Robert Macey. Cette découverte fut la première mise en évidence directe d’un type de protéine capable de faciliter les mouvements d’eau à travers une membrane biologique : c'est l'aquaporine.
Depuis 1991, beaucoup d'autres protéines de ce genre ont été découvertes et agrandissent ainsi la famille des aquaporines. Toutes laissent passer sélectivement les molécules d’eau (et parfois le glycérol).
On notera cependant que l'aquaporine 4 semble être une exception à cette inhibition puisque le mercure ne désordonne pas sa structure et n'influe pas sur son fonctionnement, contrairement aux autres aquaporines.
A l’heure actuelle, près de 200 aquaporines ont été répertoriées, aussi bien dans le règne animal que végétal et on en connaît notamment 10 chez l'Homme. Celles-ci sont notées "AQP" suivi d’un chiffre (entre 1 et 10) qui correspond à leur ordre chronologique de découverte.
 |
| Les aquaporines de l'organisme humain
Sources :
|
Ce commentaire a été supprimé par l'auteur.
RépondreSupprimer